关于盐类水解反应的说法正确的是
| A.溶液呈中性的盐一定是强酸强碱生成的盐 |
| B.含有弱酸根离子的盐的水溶液一定呈碱性 |
| C.盐溶液的酸碱性主要决定于形成盐的酸、碱性的相对强弱 |
| D.同浓度的NH4Cl和NaCl pH之和大于14 |
滴加新制氯水后,下列各组离子还可能大量存在的是
| A.Fe3+、Al3+、Cl-、NO3- | B.K+、Na+、I-、SO42- |
| C.Ag+、Ca2+、NH4+、NO3- | D.Na+、Ba2+、CO32-、SO42- |
下列离子方程式书写正确的是
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O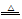 Fe(OH)3+3H+ Fe(OH)3+3H+ |
| B.一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ |
| C.用氢氧化钠溶液吸收过量二氧化碳 OH—+CO2=HCO3— |
| D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ +2I-=2Fe2+ + I2 |
下列实验操作中,错误的是
| A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B.配制90mL1mol/L的NaOH溶液选用100 mL容量瓶 |
| C.用pH试纸测得新制氯水的pH为2 |
| D.用酸式滴定管准确量取10.00mLKMnO4溶液 |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.K值不变,平衡可能移动 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |