1、已知X、Y、Z、W为四种短周期主族元素,它们的原子序数依次增大,其中X、Y、W位于不同周期,Y是形成化合物种类最多的元素,Z可形成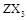 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。
(1)由X、Y组成的最简单化合物可作为某燃料电池的 极反应物。
(2)化合物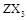 所含化学键种类为
所含化学键种类为  ,属于 化合物(填
,属于 化合物(填 “离子”或“共价”)。
“离子”或“共价”)。
(3)写出实验室制备W单质的化学方程式为 。
Ⅱ、铁及其化合物在生活、生产中有广泛应用。请回答下 列问题:
列问题:
(1) 黄铁矿(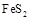 )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为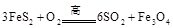 ,有3mol
,有3mol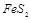 参加反应,转移 mol电子。
参加反应,转移 mol电子。
氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(2) 与明矾相似,硫酸铁也可用作净水剂,其原理是 。
。
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。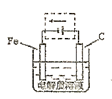
[化学——选修物质结构与性质]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
A. g/mol B.
g/mol B. g/mol
g/mol
C. g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
原子的电子排布图为 |
| B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
| C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D |
二价阳离子与C的阴离子具有相同的电子层结构 |
| E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为;
(2)B的氢化物的分子空间构型是;
(3)E在周期表中的位置是,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为;
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:。
[化学—选修化学与技术]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.水处理技术在生产、生活中应用广泛。
(1)含有较多离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过(填“RH”或“ROH”)型离子交换树脂,原因是。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为。电渗析法净化水时,使离子通过半透膜的推动力是。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的。
(13分)一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
(1)图中曲线(填“a”或“b”)表示使用催化剂时的反应进程。使用催化剂对该反应的影响是______(填选项字母)。
| A.提高反应速率 | B.提高CO2的转化率 |
| C.降低反应活化能 | D.改变反应的ΔH |
(2)CO2(g)+3H2(g) CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
(3)用含E1、E2的表达式表示CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
(4)一定温度下,在体积为2L的容积固定的密闭容器中,充入2molCO2、6molH2,经10min反应达到平衡状态W,生成1molCH3OH。CO2的转化率为________。从反应开始到平衡,用H2的浓度变化表示的平均反应速率v(H2)=____________。该温度下,在体积为1L的容积固定的密闭容器中,从逆反应开始建立化学平衡,且各组分的平衡浓度与平衡状态W完全相同,则起始时充入容器的n(CH3OH)=________,n(H2O)=________。
(7分)某同学用铅蓄电池作电源,用石墨作电极电解500mL某浓度的AgNO3溶液,观察到A电极表面有金属生成,B电极上有无色气体产生。当溶液中原有溶质完全电解后,停止通电,取出A极,洗涤、干燥、称量,电极增重5.4g。已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请按要求回答下列问题:
(1)A电极为电解池的_____极,B电极上产生的气体为_________。
(2)电解前AgNO3溶液的物质的量浓度为____________。
(3)当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为
mol。
(4)铅蓄电池放电时,负极质量______,正极质量_________,电解液的pH_____(填“增大”、“减小”或“不变”)。
(8分)现有室温的①HCl ②H2SO4 ③CH3COOH三种溶液。
(1)若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是___________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
(2)若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________,三种酸溶液各取1mL,分别加水稀释到1000mL,pH最小的是_________。