在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应。平衡时有关数据如下
(已知相同条件下:2SO2+O2 2SO3 △H =-196.6kJ/mol)。
2SO3 △H =-196.6kJ/mol)。
| 容器 |
甲 |
乙 |
丙 |
丁 |
| 起始投入量 |
2m olSO2+1molO2 olSO2+1molO2 |
1molSO2+0.5molO2 |
2molSO3 |
2molSO2+2molO2 |
| 反应放出或 吸收的热量(kJ) |
a |
b |
c |
d |
| 平衡时c(SO3)(mol/L) |
e |
f |
g |
h |
下列关系正确的是
A. a=c;e="g " B. a>2b;e>2f C. a>d;e>h D. c+98.3e=196.6
“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于
| A.氧化物 | B.盐 |
| C.金属或合金 | D.碱 |
下列原子结构示意图正确的是
A. |
B.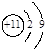 |
C. |
D.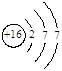 |
气体的体积主要由以下什么因素决定的
①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离
④气体分子的相对分子质量
| A.①② | B.①③ | C.②③ | D.②④ |
下列溶液中,c(Cl-)与50mL 1 mol/L的AlCl3溶液中c(Cl-)相等的是
| A.150mL 1 mol/L的NaCl溶液 |
| B.75mL 2 mol/L的NH4Cl溶液 |
| C.150mL 3 mol/L的KCl溶液 |
| D.75mL 1 mol/L的BaCl2溶液 |
Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
| A.Na2CO3是碱 | B.Na2CO3是盐 |
| C.Na2CO3是钠盐 | D.Na2CO3是碳酸盐 |