金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。
【实验目的】 测定金属铁、铜和镁的活动性强弱
【所用试剂】 稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】
步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。
【实验记录】用“√”表示能观察到实验现象,用“—”表示观察不到实验现象(见下表)。
⑴通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是
⑵运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是 。写出镁和稀硫酸反应的化学方程式 ,此反应属于 。
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是 (用元素符号表示)
【反思交流】 若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是 。
Ⅰ.探究:实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%” 字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究。
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是 A.酸 B.碱 C.盐
查阅资料:
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3和NaHCO3溶液都呈碱性。
③测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度g |
36 |
109 |
215 |
9.6 |
得出结论:小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是。
设计实验并继续探究:
①小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是。
②小强为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取样于试管中,滴加 |
产生大量的气泡 |
该溶液是,反应的化学方程式 |
拓展与应用:确定该溶液还可以选择与小强不同的试剂,你选择的试剂是(要求类别不同),对应的现象是。
反思与评价:小淇认为上述探究存在问题,她的理由是。
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g·mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如右下图所示的关系,
求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)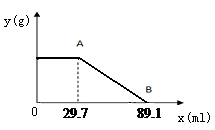
食盐是生活必需品,也是重要的化工原料。
(1)电解饱和食盐水可以得到多种化工产品,主要过程如下:
①气体A是密度最小的气体,该气体的名称为,写出一个由酸D转化为气体A的化学方程式。
②电解后生成的碱B的化学式为,你猜想的依据是。
(2)食盐中含有各种添加剂,如添加碘酸钾(KIO3)补充碘元素、添加亚铁氰化钾(K4[Fe(CN)6]·3H2O) 作为抗结剂防止食盐结块。但人们总是担心抗结剂会分解产生剧毒物质氰化钾(KCN)。某同学对此进行了探究,其热重分析数据如图: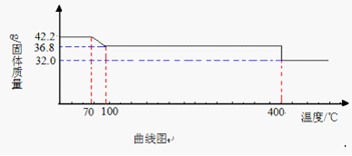
【查阅资料】一般烹饪温度低于340℃。
回答下列问题:
①食盐中至少含有种金属元素(填一数字)。
②写出70℃~100℃反应的方程式;
当温度高于400℃时,会产生剧毒物质KCN,同时还会产生一种单质气体,则X的化学式是。
③食用含亚铁氰化钾作抗结剂的食盐是否安全?其理由是。
请结合图示实验装置,回答下列问题。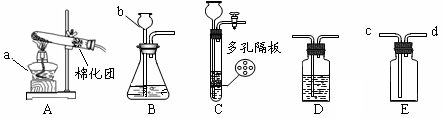
(1)图中a、b仪器的名称:a,b。
(2)用高锰酸钾固体制氧气,选用的发生装置是(填“A”、“B”或“C”),装入药品前应先进行的操作是,反应的化学方程式是。
(3)某同学在实验室用C装置(多孔隔板用来放块状固体)制取CO2,反应的化学方程式为, C装置与B装置相比较,优点为(答出一点即)。
(4)实验室用B装置制取H2时,b中应加入。如要获得干燥的气体,除发生装置外,还应选用盛放(填写试剂名称)的D装置。如用E装置收集H2,则气体应从端通入(填“c”或“d”)。
为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 |
实验操作 |
实验现象 |
| ① |
加入适量稀盐酸 |
有微量气泡,固体全部溶解,得到澄清溶液 |
| ② |
加入适量蒸馏水 |
固体部分溶解 |
| ③ |
加入适量无水乙醇 |
固体部分溶解 |
【得出结论】由实验①可判断假设c(填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是。
(4)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?(填“能”或“不能”),分别从设计方法和操作可行性的角度,具体说明理由
。
做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与。
[问题1] 细铁丝在氧气中燃烧为什么会“火星四射”?
[查阅资料1]①日常生活中的钢铁制品都含有少量碳杂质。 ②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
[设计实验]为了探究细铁丝在纯氧中燃烧产生“火星四射”现象的原因,该小组同学设计的实验方案是:取长短粗细相同的含碳细铁丝和不含碳的细铁丝,分别在足量的氧气中燃烧,观察现象。你认为他们的方案(填“合理”或“不合理”)。
[实验探究1]小明做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋状,一端系在一根铁丝上,另一端系上一根火柴。点燃火柴后迅速把铁丝连同火柴一起插入集气瓶下部(没有接触到细沙,如图所示),但不见铁丝燃烧,反复实验均未成功。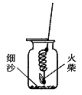
该同学认为可能导致失败的原因主要有三种:
A.铁丝表面有锈迹,影响了反应的进行;
B.点燃火柴后立即将它伸入瓶内,火柴燃烧消耗了氧气,不利于铁丝的燃烧;
C.火柴燃烧时有大量的热量放出,将铁丝和火柴迅速伸至集气瓶下部,因热胀冷缩之故。瓶内氧气会膨胀逸出,使铁丝无法燃烧。
实验:根据以上假设,他对实验应作的相应改进为:
(1);(2);(3) 。
[问题2]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料2] ①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);②铁的氧化物均能溶于酸的溶液。
[实验探究2]将冷却后的黑色物质碾碎,装入试管,加入_____溶液,观察到的现象是_____,说明铁燃烧时溅落下来的黑色物质中还含有铁。
[问题3]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料3]①Fe3O4和Fe2O3的分解温度、铁的熔点见表:②Fe2O3高温时分解成Fe3O4。
| Fe3O4 |
Fe2O3 |
铁 |
|
| 分解温度/℃ |
1538 |
1400 |
— |
| 熔点/℃ |
— |
— |
1535 |
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在_____之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4。
[拓展延伸]
(1)小林同学发现“铁丝”在纯净氧气中燃烧起来,观察到火星四射,并有黑色固体生成,请写出该反应的化学方程式;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式__________;
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色_____,就说明包装盒破损进气,这样售货员就能及时发现并处理。