某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化,据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2) 根据上述框图反应关系,写出下列B、D所含物质的化学式
根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B ;沉淀D 
(3)写出①、②、两个反应的离子方程式
①
②
由人尿分离出来的结晶化合物A,熔点为187~188 ℃。对化合物A做下列实验:
(1)测得A的蒸气密度为8.00 g·L-1(已折合成标准状况),取17.92 g A完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10 g。剩余气体通过碱石灰,气体质量减轻39.60 g;另取17.90 g A完全分解,可得标准状况下氮气1.12 L,试通过计算确定A的化学式_______。
(2)又知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 mol A水解生成1 mol B和1 molC。已知A、B、C三物质分子中均含有1个羧基;B物质仅由碳、氢、氧3种元素组成,其物质的量之比为7∶6∶2;C俗名为甘氨酸。写出A、B、C的结构简式。A_______,B_______,C_______。
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
A. 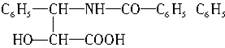 —是苯基
—是苯基
B.R—OH(R是一个含有C、H、O的基团)
(1)A可在无机酸催化下水解,其反应的方程式是___________________________。
(2)A水解所得的氨基酸,不是天然蛋白质水解产物,因为氨基不在____(填希腊字母)位。
(3)写出ROH的分子式_________________________。
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学和医学奖。
请完成下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N 4种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________。D是双原子分子,相对分子质量为30,则D的分子式为________。
(2)油脂A经下列途径可得到M。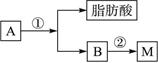
图中②的提示: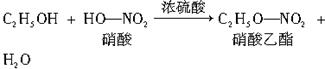
反应①的化学方程式是______________________________________________________。
反应②的化学方程式是______________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:______________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________g金属钠。
某天然油脂A的分子式为C57H106O6,1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:_____________________________。
(2)写出C的结构简式:___________________________。
C的名称:________________________。
(3)写出含有5个碳原子的C同系物的同分异构体的结构简式:___________________。
已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如: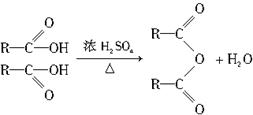
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。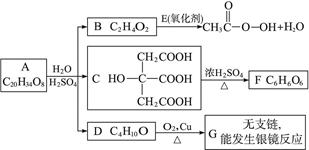
(1)CH3COOOH称为过氧乙酸,写出它的一种用途_______________。
(2)写出B+E→CH3COOOH+H2O的化学方程式____________________。
(3)写出F可能的结构简式____________________。
(4)写出A的结构简式________________________。
(5)1 mol C分别和足量的金属Na\,NaOH反应,消耗Na与NaOH物质的量之比是_______。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:____________________________________。