25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,下列说法正确的是
| A.该溶液的pH一定是10 | B.该溶液可能pH="4" |
| C.该溶液的pH可能是7 | D.不会有这样的溶液 |
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.增大反应物的量,一定会加快正反应速率,使平衡向正反应方向进行 |
| C.化学平衡发生移动,平衡常数不一定发生变化 |
| D.反应物的转化率减少,平衡一定向逆反应方向移动 |
一定量的盐酸跟少量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入
| A.KNO3溶液 | B.NaCl溶液 | C.铜粉 | D.硫酸铜晶体 |
下列说法正确的是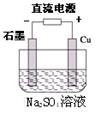
| A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现 |
B.在体积可变的密闭容器中进行反应:CaCO3(s) CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 |
| C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)] |
D.在密闭容器中进行反应:HI(g)  1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 |
关于下列三个反应的说法正确的是
①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②2H2O(g) ===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
③稀溶液中,H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1
| A.碳的燃烧热的数值等于110.5 kJ·mol-1 |
| B.H2的热值为142.9kJ·g-1 |
| C.10mL0.1mol·L-1的H2SO4溶液和5mL 0.1mol·L-1NaOH溶液混合,中和热小于57.3 kJ/mol |
| D.常温常压下,反应①一定能自发进行 |
人体血液内的血红蛋白(
)易与
结合生成
,因此具有输氧能力,
吸入肺中发生反应:
 ,37 ℃时,该反应的平衡常数
=220。
的浓度达到
浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
,37 ℃时,该反应的平衡常数
=220。
的浓度达到
浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
| A. | 与 反应的平衡常数 = |
| B. | 人体吸入的 越多,与血红蛋白结合的 越少 |
| C. | 当吸入的 与 浓度之比大于或等于0.02时,人的智力才会受损 |
| D. | 把 中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向逆反应方向移动 |