下列叙述错误的是
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液  混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) |
| B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+) |
| C.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
| D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
有机物CH3—CH==CH—Cl能发生 ( )
①取代反应,②加成反应,③消去反应,④使溴水褪色,⑤使酸性KMnO4溶液褪色,⑥与AgNO3溶液生成白色沉淀,⑦聚合反应
| A.以上反应均可发生 | B.只有⑦不能发生 |
| C.只有⑥不能发生 | D.只有②不能发生 |
由2氯丙烷制取少量的1,2丙二醇时,需要经过下列哪几步反应?( )
| A.消去→消去→取代 | B.消去→加成→水解 |
| C.取代→消去→加成 | D.消去→加成→消去 |
甲酸和乙醇发生酯化反应后生成的酯,其结构简式为()
| A.CH3COOCH2CH3 | B.HCOOCH2CH3 |
| C.CH3COOCH3 | D.HCOOCH3 |
分子组成为C9H12苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是( )
| A.该有机物不能发生加成反应,但能发生取代反应 |
| B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 |
| C.该有机物分子中的所有原子可能在同一平面上 |
| D.该有机物的一溴代物最多有6种同分异构体 |
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图所示: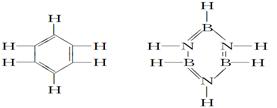
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为 ( )
| A.2 | B.3 | C.4 | D.6 |