在一个容积为2L的密闭 容器中,发生如下反应:3A+B
容器中,发生如下反应:3A+B 2C (A、B、C均为气体).若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
2C (A、B、C均为气体).若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
A.3.6mol B.3.2mol C.2.8mol D.1.6mol
下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是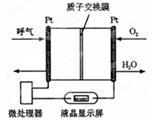
| A.电流由O2所在的铂电极流出 |
| B.该电池的负极反应式为:CH3CH2OH+3H2O -12e-=2CO2↑+12H+ |
| C.O2所在的铂电极处发生还原反应 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
在一定温度下,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。在a、b中分别加入2 mol A和2 molB,起始时容器体积均为V L,发生反应2A+B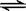 x C,并达到化学平衡状态,平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是
x C,并达到化学平衡状态,平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是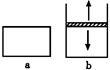
A.x的值为2
B.B物质可为固体或液体
C.平衡时,a容器的体积小于V L
D.a、b容器中从起始到平衡所需时间相同
某工厂采用电解法处理含铬废水,耐酸电解槽阴、阳极,槽中盛放含铬废水,原理示意如右图,下列说法不正确的是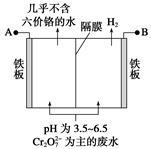
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O |
| C.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
| D.阴极区附近溶液pH降低 |
下列反应的离子方程式正确的是
| A.一定量的碳酸氢钠溶液中加入足量澄清石灰水 HCO3-+Ca2++OH-= CaCO3↓+H2O |
| B.漂白粉的稀溶液中通入过量SO2气体 Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO |
| C.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO+CO32- |
| D.Ba(OH)2溶液加入过量NaHSO4溶液中:H++SO42—+Ba2++OH—=BaSO4↓+H2O |
中和相同体积、相同pH的Ba(OH)2、NaOH、NH3·H2O三种溶液,所用相同浓度的盐酸的体积分别是V1、V2、V3,则三者的关系是
| A.V1=V2=V3 | B.V1>V2>V3 | C.V1=V2<V3 | D.V3>V1>V3 |