已知:C(s,金刚石)=C(s,石墨)△H=-1.9kJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1=-a kJ/mol
C(s,石墨)+O2(g)=CO2(g) △H2=-b kJ/mol
根据已述反应所得出的结论正确的是
| A.a>b | B.a=b | C.a<b | D.金刚石比石墨稳定 |
以下事实不能用勒夏特列原理解释的是( )
| A.增大压强,有利于二氧化硫和氧气反应生成三氧化硫 |
| B.工业制取硫酸和合成氨反应都要使用催化剂 |
| C.合成氨工业生产中,把合成塔中的氨气不断抽出 |
| D.实验室常用排饱和食盐水的方法收集氯气 |
合成氨工业采用下列措施是为了使平衡正向移动而提高反应物转化率的是()
| A.采用高温 | B.采用高压 | C.使用催化剂 | D.以上均不对 |
下列反应:2HBr(g) 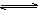 Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半,下列说法正确的是( )
Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半,下列说法正确的是( )
| A.化学反应速率不变,平衡不移动 | B.化学反应速率加快,平衡不移动 |
| C.平衡向右移动,气体颜色加深 | D.平衡不移动,气体颜色不变 |
在恒温恒容条件下,有反应2A(g)+2B(g) 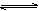 C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( )
C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( )
A.达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同
B.达平衡时,体系内混合气体的平均密度相同
C.I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D.I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
对于反应2CO(g)+ O2(g)  2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是()
2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是()
| A.恒温恒容通入He | B.再通入少量CO2 | C.温度升高 | D.加压 |