关于溶液的 酸碱性说法正确的是
酸碱性说法正确的是
| A.C(H+)很小的溶液一定呈碱性 | B.pH=7的溶液一定呈中性 |
| C.C(OH-)= C(H+)的溶液一定呈中性 | D.强酸溶液的C(H+)一定比弱酸的大 |
下列说法正确的是()
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++N =4Mg2++N =4Mg2++N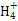 +3H2O +3H2O |
| B.常温下,0.1 mol/L一元酸HA溶液中c(OH-)/c(H+)=1×10-8,则此溶液的pH=3 |
| C.相同条件下,浓度均为0.01 mol/L的NH4Cl溶液和NaCl溶液中,前者的阳离子总浓度大于后者的阳离子总浓度 |
| D.物质的量浓度相等的醋酸和氢氧化钠溶液等体积混合后的溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是()
①电离程度增大;②c(NH3·H2O)增大;③N 数目增多;④c(OH-)增大;⑤导电性增强;⑥
数目增多;④c(OH-)增大;⑤导电性增强;⑥ 增大
增大
| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |
下表是三种难溶金属硫化物的溶度积常数(25 ℃)。
| 化学式 |
FeS |
CuS |
MnS |
| 溶度积 |
6.3×10-18 |
1.3×10-36 |
2.5×10-13 |
下列有关说法中正确的是()
A.25 ℃时,CuS的溶解度大于MnS的溶解度
B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
有常温下物质的量浓度均为0.1 mol/L的①氨水②NH4Cl溶液③Na2CO3溶液④NaHCO3溶液,下列说法正确的是()
| A.4种溶液pH的大小顺序:①>④>③>② |
B.等体积的①和②溶液混合后若pH>7:c(Cl-)>c(N ) ) |
| C.溶液①、③由水电离产生的c(OH-):①<③ |
D.溶液③、④等体积混合后,溶液中c(C )>c(HC )>c(HC ) ) |
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是()
| A.HA可能为一元弱酸 |
| B.MOH为一元强碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)="0.01" mol·L-1 |