甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是 ( )
| A.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH= +890 kJ·mol-1 |
| B.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l)ΔH= +890 kJ·mol-1 |
| C.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l)ΔH=-890 kJ·mol-1 |
D.2CH4(g) + 4 O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH= -890 kJ·m O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH= -890 kJ·m ol-1 ol-1 |
下列叙述正确的是
| A.把纯水加热,水的电离程度增大,但水仍然是中性的,pH=7 |
| B.在醋酸溶液中加入少量的CH3COONa(s),测得pH变大,主要原因是CH3COONa水解呈碱性,中和醋酸电离的H+ |
| C.pH=3的醋酸溶液,稀释至10倍后pH<4 |
| D.相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①实验过程中取出盐桥,原电池仍继续工作
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
③负极反应为:Ag+ + e- = Ag
④盐桥内的K+移向AgNO3溶液
| A.②④ | B.①② | C.②③ | D.③④ |
下列叙述中正确的是
| A.稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为 CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH = 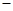 57.3kJ/mol 57.3kJ/mol |
| B.在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热 |
| C.未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境 |
| D.升高温度或加入催化剂,可以改变化学反应的反应热 |
在6KOH + 3Cl2 ="=" KClO3 + 5KCl + 3H2O的反应中,下列说法中正确的是
| A.KCl是还原产物,KClO3是氧化产物 |
| B.Cl2是氧化剂,KOH是还原剂 |
| C.KOH是氧化剂,Cl2是还原剂 |
| D.被氧化的氯原子与被还原的氯原子数之比为1∶5 |
有关纯碱和小苏打的叙述正确的是
| A.等质量的Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多 |
| B.等质量的Na2CO3、NaHCO3分别与足量的同种盐酸反应,NaHCO3消耗的盐酸多 |
| C.分别向NaHCO3和Na2CO3溶液中滴入Ba(OH)2溶液均出现白色沉淀 |
| D.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 |