向CH3COOH 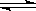 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
| A.NH4Cl固体 | B.CH3COONa | C.NH3·H2O | D.Zn粉 |
100ml 浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气总量,可采用的方法是
| A.加入少量浓盐酸 | B.加入几滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反映的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
D.同温同压下, (g)+ (g)+ (g)="===" 2HCl(g)在光照和点燃条件下△H不同 (g)="===" 2HCl(g)在光照和点燃条件下△H不同 |
将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是()
| A.m<n | B.m>n | C.m=n | D.无法确定 |
在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。反应方程式分别为:
P4 (s) + 5O2 (g) = P4O10 (s) 4P (s)+ 5O2 (g) = P4O10 (s)
由此判断,下列说法正确的是()
| A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高 |
| B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低 |
C.由红磷转化为白磷是 放热反应,等质量时红磷能量比白磷高 放热反应,等质量时红磷能量比白磷高 |
| D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低 |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.通入大量O2(容器容积不变) | B.增大容器容积 |
| C.移去部分SO2 | D.降低体系温度 |