设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.标准状况下,22.4 L四氯化碳中共价键数目为4NA |
| B.标准状况下,32 g S在足量O2中燃烧,转移的电子数为6NA |
| C.常温常压下,6 g NO2和40 g N2O4混合气体中的原子总数为3NA |
| D.在1 L 0.5 mol/LCH3COOH溶液中CH3COOH分子个数为0.5NA |
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是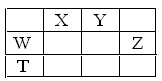
| A.X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B.由X、Y和氢三种元素形成的化合物中只有共价键 |
| C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 |
| D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
X、Y、Z、W有如图所示的转化关系,已知焓变:ΔH=ΔH1+ΔH2,则X、Y不可能是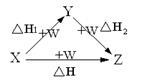
A.C、COB.AlCl3、Al(OH)3
C.Fe、Fe(NO3)2 D.S、SO3
能正确表示下列反应的离子方程式的是
| A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+===Fe2++2Fe3++4H2O |
| B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O===HClO+ HSO3- |
| D.将0.2 mol·L-1 NH4Al(SO4)2溶液与0.3 mol·L-1 Ba(OH)2溶液等体积 |
混合:2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
为提纯下列物质(括号内为杂质),选用的试剂或方法有错误的是
| 物质 |
试剂 |
分离方法 |
|
| A |
硝酸钾(氯化钠 ) |
蒸馏水 |
降温结晶 |
| B |
氢氧化铁胶体(Fe3+) |
蒸馏水 |
渗析 |
| C |
甲烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| D |
乙醇(水) |
生石灰 |
蒸馏 |
25℃时,下列各组离子在指定溶液中可能大量共存的是
| A.无色溶液中: Al3+、NH4+、Cl—、S2— |
| B.由水电离得到的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3— |
| C.0.1 mol·L-1 FeCl3溶液中: K+、Na+、AlO2—、SCN— |
| D.中性溶液中可能大量存在Fe3+、K+、Cl—、SO42- |