在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+===2As+3SnCl+6M,关于该反应的说法中正确的组合是 ( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol ④M为OH- ⑤SnCl是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.①③ |
下列表格中的图 示内容符合文字说明要求的是
示内容符合文字说明要求的是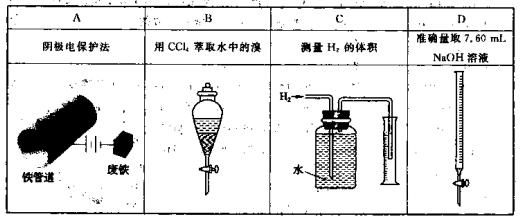
下列说法中,不正确的是
A.明矾净水过程中利用了 胶体的吸附作用 胶体的吸附作用 |
| B.不法分子制作假鸡蛋用的海藻酸钠、氯化钙以及碳酸钙都属于盐 |
| C.碳纤维、黏胶纤维、醋酸纤维都属于有机高分子材料 |
| D.广州亚运会火炬“潮流”采用丙烷(C3H6)作燃料,充分燃烧后只生成CO2和H2O |
在298K、1.01×105Pa下,将32gSO2通入1mol·L-1NaOH溶液750mL中充分反应,测得反应放出akJ的热量。已知在该条件上,1molSO2通入2mol·L-1NaOH溶液1L中充分反应放出bkJ的热量。则SO2与NaOH溶液反应生成NaHSO3的热化学方程式的正确是
| A.SO2(g)+NaOH(aq)=NaHSO3(aq)△H=-(2a-b)kJ·mol-1 |
| B.SO2(g)+NaOH(aq)=NaHSO3(aq)△H=-(4b-a)kJ·mol-1 |
| C.SO2(g)+NaOH(aq )=NaHSO3 (aq)△H=-(a-4b)kJ·mol-1 |
| D.SO2(g)+NaOH(aq)=NaHSO3(aq)△H=-(4a-b)kJ·mol-1 |
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
| c(H2)(mol·L-1) |
c(Cl2)(mol·L-1) |
v(mol·L-1·s-1) |
|
| ① |
1.0 |
1.0 |
1.0k |
| ② |
2.0 |
1.0 |
4.0k |
| ③ |
2.0 |
4.0 |
8.0k |
由此可推得,m、n值正确的是
A.m=2,n=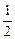 |
B.m=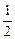 ,n= ,n=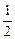 |
C.m=2,n="1" | D.m=1,n=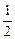 |
在一密闭容器中进行如下反应:2SO2(g) +O2(g) 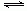 2SO3(g) ,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(g) ,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.4mol/L |