已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), 通过列式计算说明是否有沉淀产生。
通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):
肉桂醛在食品、医药、化工等方面都有应用。肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
(1)肉桂醛由C、H、O三种元素组成,质谱分析肉桂醛分子的相对分子质量为132,其分子中碳元素的质量分数为81.8%,肉桂醛的分子式是 。
肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原子,其结构简式是。(不考虑顺反异构与对映异构)
(2)已知:
I.醛与醛能发生反应,原理如下:
II.合成肉桂醛的工业流程如下图所示,其中甲为某种烃。
请回答:
①甲的结构简式是。
②丙和丁生成肉桂的化学方程式是。
(3)肉桂醛能被银氨溶液氧化,再经酸化得到肉桂酸,写出肉桂酸甲酯的结构简式。
(4)现用芳香烃A 为原料合成肉桂酸甲酯H的路线如下,测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰2︰1︰2。:
①化合物F中的官能团有 (填名称)。
②B→C的反应类型是 ,F→G的反应类型是 ,
③书写化学方程式
F→I
G→H
④G的同分异构体中,属于酯类目苯环上只有一个取代基的同分异构体有
种。其中任意一种的结构简式是
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量
分数是
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么
(2)选择的还原剂是否能用铁(填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是。
 2SO3(g)。
2SO3(g)。 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是。
容器 |
SO2(mol) |
O2(mol) |
SO3(mol) |
热量(kJ) |
甲 |
2 |
1 |
0 |
Q1 |
乙 |
1 |
|
0 |
Q2 |
丙 |
0 |
0 |
1 |
Q3 |
 2< Q3 < 197kJ
2< Q3 < 197kJ


 提高燃煤烟气中
提高燃煤烟气中 去除率的有(填字母)。
去除率的有(填字母)。
已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进 行下列实验,现象记录如下。
行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为;
(3)实验④中的现象为:;
(4)实验②反应的离子方程式是:;
(5)实验③反应的离子方程式是:_。
已知:
① 有机化学反应因反应条件不同,可生成不同的有机产品。例如:
② 苯的同系物与卤素单质混合,若在光照条件下,侧链烃基上的氢原子被卤素原子取代;若在催化剂作用下,苯环某些位置上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为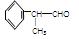 的物质,该物质是一种香料。
的物质,该物质是一种香料。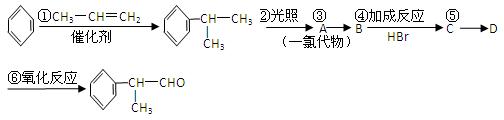
请根据上述路线,回答下列问题:
(1)A的结构简式可能为。
(2)反应③的反应类型为。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件,下同):
。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取将A直接转化为D的方法,其原因是。
(5)检验产品中官能团的化学反应方程式为:。
(6)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色;②苯环上的一溴代物有两种;③分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):