X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法正确的是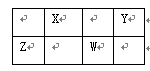
| A.常压下,四种元素单质中,W单质的熔点最高 |
| B.Z的阳离子与Y的阴离子电子层结构相同 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.W元素的金属性比Z元素金属性强 |
某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计.据此下列叙述正确的是
| A.电流计指针不会发生偏转 | B.金属铁会被腐蚀 |
| C.碳棒作负极 | D.铁表面有气体逸出 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
| A.25% | B.75% | C.88% | D.32% |
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O  H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入()
H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入()
| A.Na 2SO3固体 | B.水 | C.CaCO3固体 | D.NaOH固体 |
已知下列数据
| 化学键 |
H—H |
Cl—Cl |
H—Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 |
436kJ |
243kJ |
431kJ |
则下列热化学方程式不正确的是
A、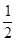 H2(g)+
H2(g)+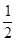 Cl2(g)="=HCl(g)" ;△H=-91.5kJ·mol-1
Cl2(g)="=HCl(g)" ;△H=-91.5kJ·mol-1
B、H2(g)+ Cl2(g)="=2HCl(g)" ;△H=-183kJ·mol-1
C、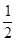 H2(g)+
H2(g)+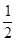 Cl2(g)="=HCl(g)" ;△H=+91.5kJ·mol-1
Cl2(g)="=HCl(g)" ;△H=+91.5kJ·mol-1
D、2HCl(g) ==H2(g)+ Cl2(g) ;△H=+183kJ·mol-1