25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: 体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.升高温度,平衡体系中c(Pb2+)增大 |
C.30℃时 ,该反应的平衡常数K>2.2 ,该反应的平衡常数K>2.2 |
| D.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
在食盐晶体中,已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是()
A.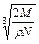 cm cm |
B.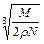 cm cm |
C.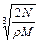 cm cm |
D.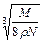 cm cm |
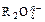 离子在一定条件下可把Mn2+氧化成
离子在一定条件下可把Mn2+氧化成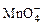 ,若反应后
,若反应后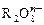 变成
变成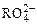 ,又知反应中氧化剂与还原剂的离子个数比为5:2,则
,又知反应中氧化剂与还原剂的离子个数比为5:2,则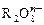 中R元素的化合价为()
中R元素的化合价为()
| A.+3 | B.+5 | C.+6 | D.+7 |
在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化的NH3的质量为()
| A.13.6g | B.10.2g | C.6.8g | D.3.4g |
某反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为()
| A.N2 | B.NO | C.NO2 | D.NH4Cl |
下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是()
| A.Na+ NO3- AlO2- SO42- | B.Na+ NO3- SiO32- K+ |
| C.K+ Cl-AlO2- CO32- | D.Na+ Cl- HCO3-Ca2+ |