已知H2(g)+I2(g) 2HI(g)△H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g)△H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲中加入0.1molHe,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
北京大学和中科院的化学工作者已成功研制出碱金属与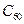 形成的球碳盐
形成的球碳盐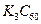 。实验测知该物质属于离子晶体,具有良好的超导性。下列关于
。实验测知该物质属于离子晶体,具有良好的超导性。下列关于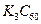 的组成和结构的分析中,正确的是()
的组成和结构的分析中,正确的是()
A.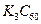 中既有离子键,又有非极性键 中既有离子键,又有非极性键 |
B.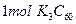 中含有的离子数目为 中含有的离子数目为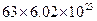 |
| C.该晶体能导电,但在熔融状态下不能导电 |
D.该物质的化学式可写为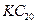 |
某物质熔融状态可导电,固态可导电,将其投入水中水溶液也可导电,则可推测该物质可能是()
| A.金属 | B.非金属 | C.可溶性碱 | D.可溶性盐 |
用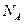 表示阿伏加德罗常数的值。下列叙述正确的是()
表示阿伏加德罗常数的值。下列叙述正确的是()
A.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为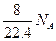 |
B.常温常压下,每生成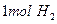 时转移的电子数为 时转移的电子数为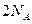 |
C.常温常压下,46g二氧化氮和四氧化二氮混合物中含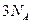 个原子 个原子 |
D.1mol含5个碳原子的有机物,最多形成碳碳单键数为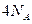 |
下列化学用语,正确的是()
| A.双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+===2Mn2++4O2↑+6H2O |
B. 的电离方程式: 的电离方程式: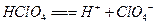 |
C.电解氢氧化钠溶液铁作阳极的电极方程式为: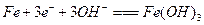 |
| D.表示中和热的热化学方程式:2NaOH(aq)+H2SO4(aq) ===Na2SO4(aq)+2H2O(l) |
2009年10月1日晚,为庆祝新中国成立60周年全国各地燃放的焰火在寂静的夜空绽放出绚丽多姿的画面,这是利用了一些金属元素在燃烧时产生不同的颜色的原理,如含有钙、钾、铜元素的化合物能产生砖红色、紫色、绿色的火焰。结合我们学过的知识,下列关于钙、钾、铜的冶炼方法正确是()
| A.电解法热分解法热还原法 | B.电解法电解法热还原法 |
| C.热还原法热分解法电解法 | D.电解法电解法热分解法 |