研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质 ,使用时加入水即可放电。关于该电池的下列说法不正确的是
,使用时加入水即可放电。关于该电池的下列说法不正确的是
| A.水既是氧化剂又是溶剂 | B.放电时正极上有 氢气生成 氢气生成 |
| C.放电时OH-向正极移动 | D.总反应为:2Li+2H2O="==" 2LiOH+H2↑ |
将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应: NH4Br(s)  NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)  Br2(g)+H2(g);2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上
Br2(g)+H2(g);2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上
述反应速率用 (NH3)表示,下列反应速率正确的是
(NH3)表示,下列反应速率正确的是
| A.0.5mol/(L·min) | B.2.5mol/(L·min) | C.2mol/(L·min) | D.5mol/(L·min) |
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2-以下叙述中错误的是
NH4++NH2-以下叙述中错误的是
| A.液氨中含有NH3、NH4+、NH2-等微粒 |
| B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数 |
| C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-) |
| D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-) |
用水稀释0.1 mol·L-1的CH3COOH溶液,其中随水的量增加而增大的是([ ]表示浓度)
| A.①②③ | B.②③⑤ | C.④⑤ | D.④⑤⑥ |
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是 ① K+、Cl-、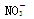 、S2- ②K+、Fe2+、I-、
、S2- ②K+、Fe2+、I-、 ③Na+、Cl-、
③Na+、Cl-、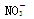 、
、
④Na+、Ca2+、Cl-、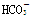 ⑤K+、Ba2+、Cl-、
⑤K+、Ba2+、Cl-、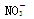
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
下列有关电解质的说法中正确的是
| A.强电解质一定是离子化合物 |
| B.强电解质、弱电解质的电离都是吸热过程 |
| C.强电解质的饱和溶液一定是浓溶液 |
| D.强电解质在水中一定能全部溶解 |