如下图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是
| A.浓盐酸附近产生白烟:NH3与HCI气体反应产生了NH4C1固体 |
| B.浓硫酸附近无明显现象:NH3与浓硫酸不发生反应、 |
| C.氯化物溶液变浑浊:该溶液一定是A1CI3溶液 |
| D.干燥红石蕊试纸不变色,湿润的红石蕊试纸变蓝:NH3是一种可溶性碱 |
下列性质中,可以证明某化合物内一定存在离子键的是()
| A.晶体可溶于水 | B.具有较高的熔点 |
| C.水溶液能导电 | D.熔融状态能导电 |
下列各分子中,所有原子都满足最外电子层上有8电子的结构的是()
| A.H2O | B.PCl3 | C.SO2 | D.BF3 |
根据相关化学原理,下列判断正确的是()
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若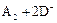 ═
═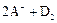 ,则氧化性:D2>A2
,则氧化性:D2>A2
C.若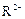 和
和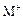 的电子层结构相同,则原子序数:R<M,离子半径:
的电子层结构相同,则原子序数:R<M,离子半径: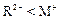
D.若弱酸HA、HB的酸性HA>HB,则溶液的碱性NaA>NaB
实现下列变化时,需克服相同类型作用的是()
| A.纯碱和烧碱的熔化 | B.水晶和干冰的熔化 |
| C.食盐和冰醋酸的熔化 | D.液溴和液汞的气化 |
节能减排指的是减少能源浪费和降低废气排放,下列措施与节能减排不符合的是()
| A.工业制硫酸时,设置“废热”锅炉产生蒸气,用于发电 |
| B.开采更多的能源,提高能源开采量 |
| C.燃烧煤的锅炉采用类似沸腾炉的锅炉 |
| D.推广使用乙醇汽油从而减轻大气污染,改善大气环境 |