理论上,不能设计为原电池的化学反应是: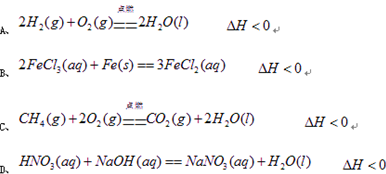
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
| A.该反应在T1、T3温度时达到化学平衡 |
| B.该反应在T2温度时达到化学平衡 |
| C.该反应的逆反应是放热反应 |
| D.升高温度,平衡会向正反应方向移动 |
在100mLH2SO4、CuSO4的混合液中,用石墨做电极电解,两极均收集到2.24L气体(标准状况),则原混合液中Cu2+的物质的量浓度为
| A.1 mol •L-1 | B.2 mol •L-1 | C.3 mol •L-1 | D.4 mol •L-1 |
在1100℃,一定容积的密闭容器中发生反应:FeO(s) + CO(g)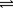 Fe(s) + CO2(g) ΔH ="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s) + CO2(g) ΔH ="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
| A.若增加CO的用量,上式中的ΔH增大 |
| B.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C.若升高温度,则正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L |
下图为某种甲醇燃料电池示意图,工作时电子流方向如图所示。下列判断正确的是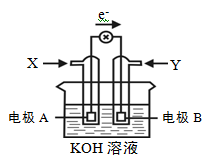
| A.X为氧气 |
| B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+ |
| C.B电极附近溶液pH增大 |
| D.电极材料活泼性:A>B |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是 
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2+ + 2e- = Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |