现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N 2+===M2++N
2+===M2++N
②P+2H2O(冷)===P(OH)2+H2↑
③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑
判断它们的还原性由强到弱的顺序是 ( )
| A.M、N、P、E | B.P、M、N、E |
| C.M、N、E、P | D.E、P、M、N |
下列溶液中,Cl-的物质的量浓度最大的是
| A.100 mL 0.5 mol/L AlCl3(aq) |
| B.200 mL 0.5 mol/L MgCl2(aq) |
| C.400 mL 0.7 mol/L BaCl2(aq) |
| D.300 mL 1 mol/L NaCl(aq) |
下列关于化学基本概念和基本理论的几点认识中正确的是
| A.胶体区别于其它分散系的本质特征是具有丁达尔现象 |
| B.根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 |
| C.胶体能透过半透膜 |
| D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)  4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是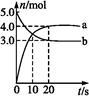
| A.0~20 s内平均反应速率v(N2O5)="0.1" mol·(L·s)- 1 |
| B.10 s时,正、逆反应速率相等,达到平衡 |
| C.20 s时,正反应速率大于逆反应速率 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
已知:C(s)+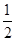 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1①
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1①
C(s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1②
计算反应C(s)+CO2(g)===2CO(g)的反应热ΔH的值为
| A.-283.01 kJ·mol-1 |
| B.+172.51 kJ·mol-1 |
| C.+283.1 kJ·mol-1 |
| D.+504.00 kJ·mol-1 |
一定条件下,可逆反应C(s)+CO2(g) 2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.①② | D.①③④ |