常温时,下列关于电解质溶液的叙述正确的是 ( )
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 |
| C.等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- |
| B.澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl- |
| C.0.1 mol·L-1 Na2CO3溶液:NH4+、Fe2+、SO42-、NO3- |
| D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、MnO4- |
下列有关化学用语表示正确的是
A.中子数为20的氯原子: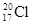 |
B.CO2的比例模型: |
C.铝原子的结构示意图: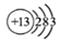 |
D.聚丙烯的结构简式: |
化学与材料、生活和环境密切相关。下列说法不正确的是
| A.“地沟油”禁止食用,但可用来制造肥皂 |
| B.煤经过气化或液化处理,可获得清洁能源等 |
| C.塑料、聚酯纤维和光导纤维都属有机高分子材料 |
| D.开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
D. 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 (25℃) |
Ka=1.77×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)