设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA |
| B.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA |
| C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA |
| D.电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.3NA |
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
下列判断正确的是
| A.ΔH>0 a+b>c | B.ΔH<0 a+b<c |
| C.ΔH<0 a+b>c | D.ΔH>0 a+b<c |
“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是
| A.ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O |
| B.第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 |
| C.工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质 |
| D.BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中一定不成立的是
| A.Mg(NO2)2、NO2、O2 | B.MgO、NO2、O2 |
| C.Mg3N2、O2 | D.MgO、NO2、N2 |
下列有关实验装置进行的相应实验,能达到实验目的的是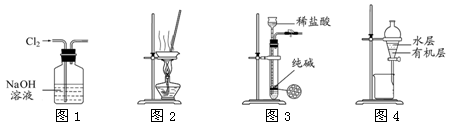
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是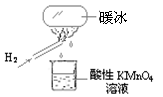
| A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
| C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 |
| D.该条件下H2燃烧的产物中可能含有一定量的H2O2 |