下表所列各组物质中,不能通过一步反应实现如图所示转化的是
| 物质 选项 |
a |
b |
c |
| A. |
Cu |
CuSO4 |
CuO |
| B. |
Fe |
FeCl3 |
FeCl2 |
| C. |
AlCl3 |
Al(OH)3 |
NaAlO2 |
| D. |
Na2O2 |
Na2CO3 |
NaOH |
一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压X物质的量分数。在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便。下列说法不正确的是()
A.对于C2H4 (g) + H2O(g) = C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1 mol,则用分压表示的平衡常数Kp = 3/P
B.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)=2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动
C.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)=2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充人3molN2,则平衡正向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I=I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。某同学为测定上述平衡体系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmol•L-1的Na2S203溶液进行滴定(反应为I2+2Na2S2032NaI+Na2S406),消耗V2mL的Na2S203溶液。 根据V1、V2和c可求得c(I2)。下列对该同学设计方案的分析,正确的是
| A.方案可行,能准确测定溶液中的c(I2) |
| B.方案可行,可采用淀粉做该滴定反应的指示剂 |
| C.不可行,只能测得溶液中c(I2)与c(I3-)之和 |
| D.不可行,因为I能与Na2S203溶液反应 |
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素—一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎 叶中提取的,其结构简式如右图,下列说法不正确的是
| A.该分子中有6个手性碳原子 |
| B.它的分子式为C15H2205 |
| C.因其具有过氧基团,它不稳定,易受湿、热和还原性物质的影响而变质 |
| D.它在常见有机溶剂中的溶解度大于在水中的溶解度 |
四种短周期元素在周期表中的位置如图,其中X元素的原子最外层电子数等于其电子层数。下列说法不正确的是()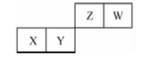
| A.X位于元期表中第3周期、ⅢA族 |
| B.原子半径:X>Z>W |
| C.最简单气态氢化物的热稳定性:W>Y |
| D.Y的最高价氧化物可以和W的最简单氢化物反应 |
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
| 选项 |
现象或事实 |
解释 |
| A |
用浸有酸性高猛酸钾溶液的硅藻土作水果保鲜剂 |
酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B |
用氢氟酸蚀刻玻璃 |
Si02虽然是酸性氧化物,但能溶于氢氟酸 |
| C |
过氧化钠作呼吸面具中的供氧剂 |
过氧化钠是强氧化剂,能氧化二氧化碳 |
| D |
Al(OH)3用作塑料的阻燃剂 |
Al(OH)3受热易分解,产生水吸收热量 |