已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H=+255.6KJ. mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)△H=+13.8KJ. mol-1
则下列说法不正确的是( )
| A.降低温度,可提高b路线中乙醇的转化率 |
| B.从能量消耗的角度来看,b路线制氢更加有利 |
| C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源 |
| D.由a、b知:2 H2(g)+O2(g)="=2" H2 O(g)△H=-483.6KJ. mol-1 |
室温下,下列各组离子在指定溶液中能大量共存的是()
A. l.0×l0-13mol/L溶液中:SiO32—、K+、SO42—、Br— l.0×l0-13mol/L溶液中:SiO32—、K+、SO42—、Br— |
| B.饱和氯水中:Cl—、NO3—、Na+、SO32— |
| C.Na3S溶液中:SO42—、K+、C1—、Cu2+ |
| D.使pH试纸呈蓝色的溶液:NO3—、I一、Na+、Al3+ |
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量,n与加入NaOH溶液的体积V的变化如右图所示
 。则下列说法不正确的是()
。则下列说法不正确的是()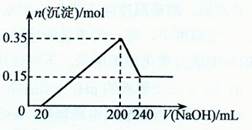
| A.混合物溶解时转移电子的数目为0.9NA |
| B.生成氢气的体积为10.8L |
| C.最初20 mLNaOH溶液用于中和过量的硫酸 |
| D.硫酸的物质的量浓度为2.5 mol·L-l |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是()
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均形成致密的氧化物保护膜 |
| C.制备A1Cl3、FeC13、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解A1Cl3、FeC13、CuCl2的混合溶液在阴极上依次析出Cu、Fe、A1 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是()
A.电解饱和食盐水时,阳极的电极反 应式为:2CI—→Cl2↑+2e— 应式为:2CI—→Cl2↑+2e— |
| B.氢氧燃料电池的负极反应式:O2+2H2O+4e—→4OH— |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu→Cu2++2e— |
| D.钢铁发生电化学腐蚀的正极反应式:Fe→Fe2++2e一 |
下列叙述正确的是()
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Al分别与不足量的稀硫酸反应所得溶液均呈中性
C.Li、Na、K的原子半径和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强