高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能净水的处理剂。工业制备高铁酸钾的离子反应方程式为:Fe(OH)3+ C1O—+ OH—→FeO42—+C1—+ H2O(未配平)
下列有关说法不正确的是( )
| A.由上述反应可知,Fe(OH)3的氧化性强于FeO42— |
| B.高铁酸钾中铁显+6价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为3: 2 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
下列选项中,表示VA族某元素原子结构示意图的是
A. |
B.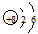 |
C.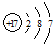 |
D. |
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: N+
N+ He→
He→ O+
O+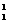 H下列叙述正确的是
H下列叙述正确的是
A. O原子核内有9个质子 O原子核内有9个质子 |
B. H原子核内有1个中子 H原子核内有1个中子 |
| C.O2和O3互为同位素 | D.32He和42He是两种不同的核素 |
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
| A.元素周期表含元素最多的族是第ⅢB族 | B.元素周期表有18个族 |
| C.第ⅠA族的元素全部是金属元素 | D.长周期是指第四、五、六周期 |
医学研究证明,用放射性135 53I治疗肿瘤可收到一定疗效,下列有关135 53I叙述正确的是
| A.135 53I是碘的一种同素异形体 |
| B.135 53I位于元素周期表中第5周期ⅦA族 |
| C.135 53I是一种新发现的元素 |
| D.135 53I核内的中子数与核外电子数之差为29 |
下列关于元素周期律的说法正确的是
| A.非金属性:N<Si | B.稳定性:HF>H2S |
| C.碱性:Ca(OH)2 <Mg(OH)2 | D.酸性强弱:H3PO4<H2SO4 |