下列化学反应的离子方程式错误的是( )
| A.Al(OH)3与盐酸反应: Al(OH)3+3H+===Al3++3H2O |
| B.Al2O3溶于过量NaOH溶液: Al2O3+2OH-===2AlO+H2O |
| C.铁溶于稀H2SO4∶Fe+2H+===Fe2++H2↑ |
| D.Al(OH)3溶于NaOH溶液: Al(OH)3+3OH-===AlO+3H2O |
某实验小组对一含有Al3+ 的未知溶液进行了如下分析:
(1)滴入少量氢氧化钠,无明显变化;
(2)继续滴加NaOH溶液,有白色沉淀;
(3)滴入过量的氢氧化钠,白色沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是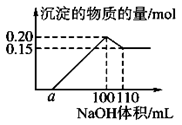
| A.该未知溶液中至少含有3种阳离子 |
| B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1 |
| C.若另一种离子为二价阳离子,则a=10 |
| D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g |
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。对下列反应的推断或解释正确的是
| 操作 |
可能的实验现象 |
解释 |
|
| A |
某溶液中加入盐酸酸化的氯化钡溶液 |
有白色沉淀生成 |
溶液中一定含有SO42- |
| B |
向淀粉KI溶液中不断通入C12 |
溶液先变蓝 后褪色 |
C12先表现氧化性、 后表现强氧化性 |
| C |
CO还原Fe2O3得到的黑色固体加入 盐酸溶解后再加入KSCN溶液 |
溶液不显红色 |
黑色固体中没有 Fe3O4 |
| D |
将SO2通入Ba(NO3)2溶液中 |
有白色沉淀生成 |
BaSO3不溶于硝酸 |
下列制备和收集气体的实验装置合理的是
| A.装置①:用氯化铵和氢氧化钙制NH3 |
| B.装置②:用铜和稀硝酸制NO |
| C.装置③:用锌粒和稀硫酸制H2 |
| D.装置④:用双氧水和二氧化锰制O2 |
下列各选项均有X、Y两种物质,将X缓缓滴入(通入)Y溶液中,无论X是否过量,均能用同一离子方程式表示的是
| A.X—稀盐酸,Y—碳酸钠溶液 |
| B.X—偏铝酸钠溶液,Y—硫酸溶液 |
| C.X—硫化氢气体,Y—氯化铁溶液 |
| D.X—二氧化碳,Y—偏铝酸钠溶液 |