已知HCN的电离常数K=6.2×10-10.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是
| A.c(CN-)>c(Na+) | B.c(CN-)>c(HCN) |
| C.c(HCN)+c(CN-)=0.2mol·L-1 | D.c(CN-)+c(OH-)=0.1 mol·L-1 |
未来氢气将作为新能源的优点的是()
①燃烧时发生氧化反应②充分燃烧的产物不污染环境
③氢气是一种再生能源④燃烧时放出大量热量
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列四种X溶液,均能跟盐酸反应,其中反应最快的是
| A.10℃ 20mL 3mol/L的X溶液 | B.20℃ 30mL 2molL的X溶液 |
| C.20℃10mL 4mol/L的X溶液 | D.10℃ 10mL 2mol/L的X溶液 |
下列反应中,属于氧化还原反应同时又是吸热反应的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.铝与稀盐酸 |
| C.灼热的炭与CO2反应 | D.甲烷与O2的燃烧反应 |
有关化学用语正确的是
| A.乙烯的结构简式 CH2CH2 | B.乙醇的分子式 C2H5OH |
C.硅原子的结构示意图为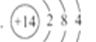 |
D.氮分子的电子式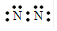 |
钫是元素周期表中第七周期第ⅠA族元素,下列关于钫性质描述不正确的
| A.在化合物中呈+1价 | B.单质能与水剧烈反应,放出氢气 |
| C.氢氧化物呈两性 | D.钫的金属性比钠强 |