(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多 0.05mol。
0.05mol。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是 (选填序号) 。
(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、 “<”、或“=”,下同) c(NH
“<”、或“=”,下同) c(NH 3·H2O), 混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)
3·H2O), 混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)
(12分)吗啡和海洛因都是严格查禁的毒品。吗啡分子中含C 71.58%、H 6.67%、N 4.91%,其余为O。已知其相对分子质量不超过300,海洛因是吗啡的二乙酸酯。
(1)吗啡的相对分子质量是______________,分子式是____________________________。
(2)海洛因的相对分子质量是_______________,分子式是_________________________。
近来研究认为松果体分泌物——“退黑素”(简称MLT)与人的寿命长短有关,有人把“退黑.素”和克隆技术并称为“20世纪生命科学的两大发现”。“退黑素”的化学结构简式为
(1)“退黑素”的分子式为________________________________________________________。
(2)“退黑素”结构简式中,虚线框内的结构名称为__________________________________,它在稀硫酸中受热后生成的具有酸性的物质为____________________________。
全球海水中溴的蕴藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:空气吹出纯碱吸收法。该方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①__________________(写出离子方程式);②Br2+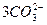 ====
====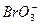 +5Br-+3CO2↑;③
+5Br-+3CO2↑;③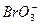 + 5Br-+6H+====3Br2+3H2O。其中反应②中的氧化剂是_________________;还原剂是_________________。
+ 5Br-+6H+====3Br2+3H2O。其中反应②中的氧化剂是_________________;还原剂是_________________。
司机是否酒后驾车,可通过对其呼出的气体进行检验而查出,所利用的化学反应为2CrO3(红色)+3C2H5OH+3H2SO4====Cr2(SO4)3(绿色)+3CH3CHO+6H2O
被检测的气体的成分是____________________,上述反应中的氧化剂是_____________,还原剂是_____________。
取8 g某有机物A(相对分子质量为32)在氧气中燃烧,生成物中只有11 g的CO2和9 g H2O,则A中一定含有______________元素,其分子式是______________;误服A会使人中毒眼睛失明甚至死亡,其化学名称为______________,写出此物质在空气中燃烧的化学方程式:_____________________________。