下列实验方案中,可以测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
①取a克混合物与足量稀盐酸充分反应,量取产生的气体体积为bmL(已折算为标况)
②取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
③取a克混合物充分加热,减重b克
A.只有①② |
B.只有②③ | C.只有③ | D.全部可以 |
如图装置,U形管中装有50 mL 2 mol 的CuSO4溶液。通电一段时间后,下列说法正确的是
的CuSO4溶液。通电一段时间后,下列说法正确的是
| A.转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B.转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C.电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D.若将石墨棒换成铜棒,可实现铁制品上镀铜 |
现有X、Y、Z三种常见短周期元素,Y、Z为同周期金属元素,且X和Y的某种化合物为淡黄色固体M,Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水。下列说法不正确的是
| A.固体M能与水反应生成X单质和一种强碱 |
| B.Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C.Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D.M和N中均含有离子键和共价键 |
芳香化合物M的结构简式为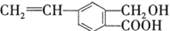 ,关于有机物M的说法正确的是
,关于有机物M的说法正确的是
| A.有机物M的分子式为C10H12O3 |
| B.1 molNa2CO3最多能消耗1 mol有机物M |
| C.1 mol M和足量金属钠反应生成22.4 L气体 |
| D.有机物M能发生取代、氧化和加成反应 |
化学与人类生活密切相关,下列与化学有关的说法不正确的是
| A.开发和推广新能源是实现低碳生活的途径之一 |
| B.化学药品着火,要立即用水或泡沫灭火器灭火 |
| C.食品添加剂虽能改善食物味道等,但需限量使用 |
| D.化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 |
工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g)ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 |
时间/min n/mol |
0 |
10 |
20 |
40 |
50 |
| T1 |
n(CH4) |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| T2 |
n(CH4) |
0.50 |
0.30 |
0.18 |
…… |
0.15 |
下列说法不正确的是
A.10 min内,T1时v(CH4)比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)