下列反应的离子方程式正确的是( )
| A.碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++H2O+CO2↑ |
| B.硫酸铝溶液中加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH |
| C.向足量的溴化亚铁溶液中通入少量氯气:2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl- |
| D.碳酸氢钠溶液与足量的氢氧化钡溶液混合: |
Ba2++2OH-+2HCO===BaCO3↓+CO+2H2O
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.常温常压下,18 g H218O含有的原子总数为3NA |
| B.标准状况下,4.2 g CH2=CH2和CH3CH=CH2的混合气体中所含有的碳原子数为0.3NA |
| C.将0.1 mol Cl2通入1 L水中,转移的电子数目为0.1NA |
| D.0.1 mol·L-1Al2(SO4)3溶液中含有的Al3+总数为0.2NA |
设nA为阿伏加德罗常数的数值,下列说法正确的是
( )
| A.常温常压下,8 g O2含有4nA个电子 |
| B.1 L 0.1 mol·L-1的氨水中有nA个NH4+ |
| C.标准状况下,22.4 L盐酸含有nA个HCl分子 |
| D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子 |
下列变化中,前者是物理变化,后者是化学反应,且都有明显颜色变化的是( )
| A.打开盛装NO的集气瓶;冷却NO2气体 |
| B.用冰水混合物冷却SO3气体;加热氯化铵晶体 |
| C.木炭吸附NO2气体;将氯气通入品红溶液中 |
| D.向品红溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
下列有关叙述正确的是( )
| A.氯化钠的水溶液能导电,食盐水是电解质 |
| B.氯气的水溶液能导电,但氯气是非电解质 |
| C.H2SO4液态时不导电,它是非电解质 |
| D.MgCl2在熔融状态下可导电,它是电解质 |
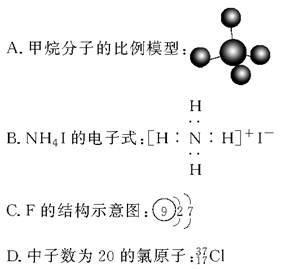
化学科学需要借助化学专业语言来描述,下列有关化学用语正确的是( )