一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是( )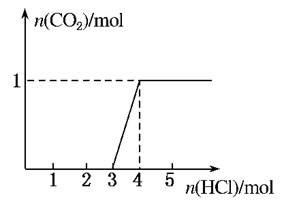
| A.通入的CO2气体在标准状况下可能大于22.4 L |
| B.A溶液中n(NaOH)=2n(Na2CO3) |
| C.A溶液中既含Na2CO3,又含NaHCO3 |
| D.A溶液中一定只有Na2CO3 |
右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )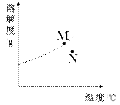
| A.从N→M:先向N中加入适量固体A再降温 |
| B.从N→M:先将N降温再加入适量固体A |
| C.从M→N:先将M降温再将其升温 |
| D.从M→N:先将M升温再将其蒸发掉部分水 |
向200C的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
| A.溶液温度末冷却到200C时,溶液一定是饱和溶液 |
| B.溶液温度末冷却到200C时,溶质质量分数比甲溶液大 |
| C.溶液温度恢复到200C时,溶液质量比甲溶液小 |
| D.溶液温度恢复到200C时,溶液的溶质质量分数和甲溶液的相等 |
某温度下硫酸铜的溶解度是25g,若温度不变,将32g无水硫酸铜粉末放入mg水中,形成饱和溶液并有胆矾晶体析出时,则m的取值范围是()
| A.18g≤m≤128g | B.36g<m<180g |
| C.18g<m<128g | D.36g≤m≤128g |
物质X2SO4的饱和溶液的密度为ρg·mL-1 ,c(x+)=" n" mol·L -1,溶质质量分数为α%, 溶质的式量为M ,溶解度为S ,下列表达式正确的是()
一定温度和压强下,乙腈(CH3CN)是极易溶于水的无色液体,这时向质量分数为a的乙腈水溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a。若同样条件下乙腈的密度为d1,水的密度为d2,则下列说法正确的是()
| A.d1<d2 | B.d1>d2 |
| C.d1=d2 | D.无法确定 |