能正确表示下列反应的离子方程式为( )
| A.少量SO2通入苯酚钠溶液中(酸性:H2SO3>HSO3->苯酚):SO2+H2O+C6H5O-=C6H5OH+HSO3― |
| B.将Na2O2固体投入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ |
| C.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br— + 2Cl2 ="=" Fe3+ + Br2 + 4Cl— |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀: |
NH4++Al3++2SO42-+2Ba2++4OH-= Al(OH)3↓+NH3·H2O+2BaSO4↓
已知Fe3O4纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH—=Fe3O4+S4O62-+2H2O,下列说法不正确的是
| A.参加反应的氧化剂与还原剂的物质的量之比为1:5 |
| B.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol |
| C.每生成1molFe3O4,则转移电子数为4mol |
| D.O2是氧化剂,S2O32-和Fe2+是还原剂 |
密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s) 2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,重新平衡后,下列叙述正确的是
2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,重新平衡后,下列叙述正确的是
| A.平衡常数减小 | B.CaO的量减少 | C.氧气浓度变大 | D.CaO2的量不变 |
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是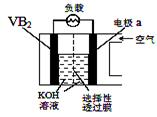
| A.电极a为电池负极 |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−- 22e−→V2O5 + 2B2O3 + 11H2O |
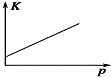
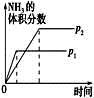
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是
| A |
B |
C |
D |
|
| 研究 目的 |
温度(T)对反应的影响(T2>T1) |
压强(p)对平衡常数的影响 |
温度(T)对反应的影响 |
压强(p)对反应的影响(p2>p1) |
| 图示 |
 |
 |
 |
 |
下列有关元素化合物的说法正确的是
| A.常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 |
| B.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Al、Fe、Cu |
| D.等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |