已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法错误的是( )
| A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 |
| B.H2(g)+F2(g)=2HF(g)△H="-270" kJ/mol ,1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
| C.相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2是一个吸热反应 |
| D.破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,则Q1+Q2<2Q3 |
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如图所示,则下列判断正确的是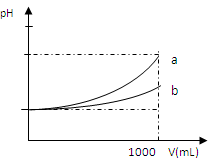
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则A为强酸,B为弱酸
C.原酸溶液的浓度c(A)>c(B)
D.若2<a<5,则A、B都是弱酸,酸性A<B
下列性质中,不能说明乙酸是弱电解质的是
| A.乙酸钠溶液显碱性 |
| B.常温时,0.1 mol·L-1乙酸溶液的pH约为3 |
| C.10mL 1mol·L-1乙酸溶液与10mL1mol·L-1的NaOH溶液恰好完全反应 |
| D.在相同温度下,同物质的量浓度的乙酸溶液的导电性比甲酸(为弱酸)溶液的弱 |
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是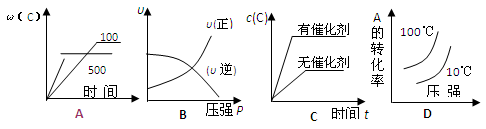
反应CO+H2O (g) 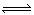 CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是
CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是
| A.将压强减小至原来的一半 | B.将反应温度升高至100℃ |
| C.添加催化剂 | D.增大水蒸气的浓度 |
有下列盐:① FeCl3② CH3COONa ③ NaCl,其水溶液的pH由大到小排列正确的是
| A.①>③>② | B.②>③>① | C.③>②>① | D.①>②>③ |