常温下,将浓度为0.1mol﹒L-1HCOOH的溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.Ka(HCOOH) | C.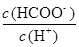 |
D.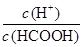 |
25℃,向纯水中加入少量的冰醋酸,有关该溶液的说法错误的是
| A.酸性增强 |
| B.c(H+)和c(OH-)的乘积增大 |
| C.pH减小 |
| D.c(OH-)减小 |
Mg(OH)2固体在水中存在下列溶解平衡:Mg(OH)2(s) 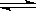 Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
| A.NaOH固体 | B.NaCl固体 |
| C.MgSO4固体 | D.NaHSO4固体 |
下列实验符合要求的是
| A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 |
| B.用托盘天平称取NaOH固体时需先在左右两盘中各放上大小相同的纸片 |
| C.若25 mL滴定管中液面的位置在刻度为10mL处,则滴定管中液体的体积一定大于15 mL |
| D.用玻璃棒蘸取溶液滴在表面皿上的已润湿pH试纸上测得其pH为12 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:K+、SO42﹣、Cu2+、Cl﹣ |
| B.0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3﹣、Cl﹣ |
| C.使甲基橙变红的溶液中:K+、HCO3﹣、Ba2+、I﹣ |
| D.c(H+)/c(OH﹣)=1×10﹣12:NH4+、Cl﹣、Ca2+、Br﹣ |