下列叙述正确的是
| A.提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
| B.氯气是瑞典化学家舍勒发现的 |
| C.海水中含有丰富的碘元素,因此碘被称为“海洋元素” |
| D.溴化银可用于人工降雨 |
投入一定量的物质A和B发生可逆反应:2A(g)+nB(g)  mC(g) ,在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的物质的量与时间的关系如右图所示, 有关该反应的说法正确的是( )
mC(g) ,在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的物质的量与时间的关系如右图所示, 有关该反应的说法正确的是( )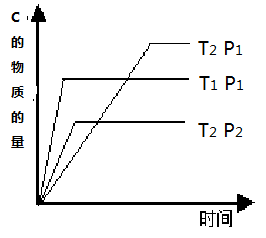
| A.n+2<m该反应正反应为放热反应 |
| B.n+2<m该反应正反应为吸热反应 |
| C.n+2>m该反应正反应为放热反应 |
| D.n+2>m该反应正反应为吸热反应 |
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
| A.平衡向逆反应方向移动 | B.a + b < c + d |
| C.Z的体积分数增大 | D.X的转化率下降 |
某温度下,反应2CH3OH(g) CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
下列说法正确的是 ()
A.CH3OH的起始浓度为1.04 mol/L B. 平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率 D.平衡时CH3OH的转化率小于80%
下列关于右图装置的说法正确的是()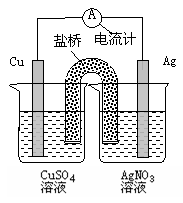
| A.银电极是负极 |
| B.铜电极上发生的反应为Cu-2e-=Cu2+ |
| C.外电路中的电子是从银电极流向铜电极。 |
| D.该装置能将电能转化为化学能 |
下列事实可以用勒夏特列原理解释的是()
| A.新制的氯水在光照条件下颜色变浅 |
| B.使用催化剂,提高合成氨的产量 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |