可以验证硫元素的非金属性比氯元素弱的 事实是
事实是
①H2S水溶液是弱酸,HCl水溶液是强酸 ②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性比硫酸强
| A.①②④ | B.②④ | C.②③④ |
D.①②③④ |
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是
| A.950mL,111.2g | B.500mL,117g |
| C.1000mL,117g | D.任意规格,111.2g |
科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A.由已知信息可得: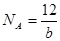 |
B.Wg该原子的物质的量一定是 |
C.Wg该原子中含有 个该原子 个该原子 |
D.该原子的摩尔质量是aNA |
在下列条件下,两种气体的分子数一定相等的是
| A.同密度、同压强的N2和C2H4 | B.同温度、同体积的O2和N2 |
| C.同体积、同密度的C2H4和CO | D.同压强、同体积的O2和N2 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.0.5moL/L、2L的AlCl3溶液中含有氯离子数为NA |
| B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA |
| D.1 L 0.1 mol/LNaCl溶液中所含的Na+的电子数为1.1NA |
下列说法中正确的是
| A.将322 g Na2SO4·10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B.将1 L 2 mol/L H2SO4溶液加水稀释到2 L,所得溶液的物质的量浓度为1 mol/L |
| C.将1 L 18.4 mol/L的H2SO4溶液加入到1 L水中,所得溶液的物质的量浓度为9.2 mol/L |
| D.将336 mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05 mol/L |