有五个系列同族元素的物质,101.3 kP时测定它们的沸点(℃)如下表所示:
| ① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
| ② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
| ③ |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
| ④ |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
| ⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列各项中不正确的是
A.a、b、c的化学式分别为Ne、Br2、HF
B.上表内物质HF和H2O,由于氢键的影响,其沸点比同族相应的氢化物要高。
C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
将78 g金属钾在空气中燃烧,生成KO2和K2O2的混合物。该混合物与足量的CO2充分反应后生成O2(4KO2+2CO2→2K2CO3+3O2),得到O2的物质的量可能为
| A.0.50 mol | B.0.75 mol | C.1.00 mol | D.1.50 mol |
将a g氯酸钾(M=122.5)充分加热分解(同时加入少量MnO2),得到b L气体,残留物充分溶解后所得溶液中共有c个溶质离子。则阿伏加德罗常数(NA)一定可表示为
A.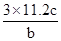 |
B. |
C. |
D.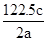 |
碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为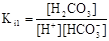 |
B.Ki2对应的电离过程是HCO3— + H2O 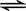 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
下列有机实验必须始终在碱性条件下进行的是
| A.银镜反应 | B.制备硝基苯 |
| C.皂化反应 | D.检验卤代烃中的卤原子 |
向含有下列微粒的溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使该微粒浓度下降的是
| A.Fe3+ | B.HS— | C.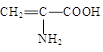 |
D.C6H5O— |