反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:
① 2NaI+MnO2+3H2SO4 =2NaHSO4+MnSO4+2H2O+I2
② 2NaIO3+5NaHSO3 =2Na2SO4+3NaHSO4+H2O+I2 
已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是
| A.I2 在反应①中是还原产物,在反应②中是氧化产物 |
| B.两个反应中生成等量的I2 时转移的电子数相等 |
| C.NaI和NaIO3 在一定条件下能反应生成I2 |
| D.NaIO3在化学反应中只能做氧化剂不能做还原剂 |
以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上(阴极产物也不再参加反应损耗),通电一段时间后,关闭电源,迅速撤去电极,若在电解后的溶液中加入4.95 g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)
| A.0.56 L | B.1.12 L | C.2.24 L | D.3.36 L |
下列叙述正确的是
A.在0.10 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO ) ) |
| B.甲烷的标准燃烧热是890.3 kJ·mol-1,则甲烷燃烧的热化学方程式是: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 |
| C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 电解 2Cu+O2↑+4H+ |
| D.以KOH为电解质溶液的甲醇燃料电池的负极电极反应式: |
CH3OH-6e-+H2O=CO2↑+6H+
下列有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:
c(CH3COO-)<c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:
c(H+)+c(M+)=c(OH-)+c(A-)
下列离子方程式不正确的是


| A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO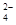 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO 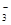 +4OH-=Mg(OH)2 ↓+2CO +4OH-=Mg(OH)2 ↓+2CO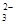 +2H2O +2H2O |
| D.在过氧化钠中加入稀硫酸:2Na2O2+4H+=4Na++2H2O+O2↑ |
一定温度下,将1molA(g)和1molB(g)充入2 L密闭容器中发生反应,在t1时达到平衡:A(g)+B(g) xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件(温度、体积、催化剂或一种物质),测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件(温度、体积、催化剂或一种物质),测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
()
| A.反应方程式中x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量D |
| D.t1~t3间该反应的平衡常数均相同 |