某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下: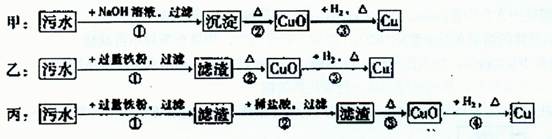
下列判断正确的是 ( )
| A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型 |
| B.乙方案中加过量铁粉可以将四种阳离子全部还原 |
| C.丙方案也发生环境污染 |
| D.三种实验方案中都能制得纯净铜 |
下列变化过程,属于放热反应的是()
①液态水变成水蒸气②酸碱中和反应③浓H2SO4稀释
④固体NaOH溶于水⑤ H2在Cl2中燃烧⑥弱酸电离
| A.②③④⑤ | B.②③④ | C.②⑤ | D.①③⑤ |
下列反应中生成物总能量高于反应物总能量的是()
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
能使酸性高锰酸钾溶液褪色的物质是
| A.苯 | B.乙炔 | C.乙烷 | D.聚乙烯 |
下列有关反应热及能量变化的说法正确的是
| A.1mol碳燃烧生成CO时所放出的热量就是碳的燃烧热 |
| B.从化石能源到能源的多元化,其中氢能属于不可再生能源 |
| C.放热反应可以自发进行,而吸热反应需加热才能进行 |
| D.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
下列关于油脂的叙述不正确的是
| A.油脂都不能使溴水褪色 | B.油脂属于酯类 |
| C.油脂无固定的熔沸点 | D.油脂在一定条件下能发生皂化反应 |