海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
注:溶液中某种离子的浓度小于1.0×10-5mo1/L,可认为该离子不存在;已知:Ksp(CaCO3)= 4.96×10-9; Ksp(MgCO3)= 6.82× 10-6; Ksp[Ca(OH)2]=4.68×l0-6; Ksp[Mg(OH)2]=5.61×l0-12。
下列说法正确的是(假设实验过程中溶液体积不变)( )
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+,不存在Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
已知常温下,在溶液中可发生如下反应:
Ce4+ + Fe2+ = Fe3+ + Ce3+, Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+
由此推断Fe2+ 、Ce3+、 Sn2+的还原性由强到弱的顺序是()
| A.Sn2+、Fe2+ 、Ce3+ | B.Fe2+ 、Ce3+、 Sn2+ |
| C.Fe2+ 、Sn2+、Ce3+ | D.Ce3+、Fe2+ 、Sn2+ |
2004年2月俄、美科学家同时宣称合成了元素周期表上的第113号和第115号元素,第115号元素的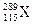 原子在生成数微秒后会衰变成
原子在生成数微秒后会衰变成 。下列有关叙述中,正确的是
。下列有关叙述中,正确的是
()
A.115号元素衰变成113号元素是化学变化 |
B.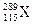 和 和 是两种核素 是两种核素 |
C.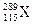 的中子数与质子数之差为174 的中子数与质子数之差为174 |
D.113号元素位于周期表第八周期 |
下列离子方程式中,正确的是()
A.在氯化亚铁溶液中通入氯气 Fe2+ + Cl2= Fe3+ + 2Clˉ |
B.三氯化铁溶液跟过量氨水反应 Fe3+ + 3NH3•H2O = Fe(OH)3↓ + 3NH4+ |
C.碳酸氢钙溶液跟稀硝酸反应 Ca(HCO3)2 + 2H+= Ca2+ + 2H2O + 2CO2↑ |
D.钠与水的反应 2Na + 2H2O = 2Na+ + 2OH- + H2↑ |
在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是()
| A.Na+、SO32-、SO42-、K+ | B.Na+、Cu2+、Br-、Ba2+ |
| C.K+、MnO4-、NO3-、Na+ | D.K+、+、SO32-、Cl- |
下列关于胶体的说法不正确的是()
A.可用渗析法提纯胶体 |
B.胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小 |
C.胶体微粒不能透过滤纸 |
D.往25mL沸水中逐滴加入2mLFeCl3饱和溶液,继续煮沸可以制得Fe(OH)3胶体 |