工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下:对上述流程中的判断正确的是( )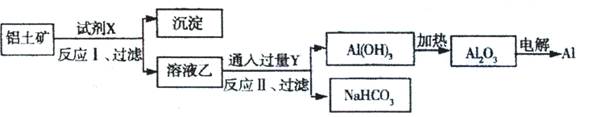
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:[A1(OH)4] +CO2=A1(OH)3↓+HCO3— |
| C.结合质子( H+)的能力由强到弱的顺序是:[Al(OH)4]->OH一>CO32— |
| D.Al2O3熔点很高,工业上还可采用电解熔融A1Cl3的方法冶炼Al |
已知298K时, N2(g)+3H2(g)="2" NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
| A.Q1 = Q2 =" 92.4kJ" |
| B.Q2 < Q1 = 92.4kJ |
| C.Q2< Q1<92.4kJ |
| D.Q2 = Q1< 92.4kJ |
某温度下,在固定容积的容器中,可逆反应: A(g)+3B(g)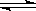 2C(g) 达到平衡时,测得平衡时的物质的量之比为A︰B︰C=2︰2︰1。保持温度不变,再以2︰2︰1的体积比充入A、B和C,则
2C(g) 达到平衡时,测得平衡时的物质的量之比为A︰B︰C=2︰2︰1。保持温度不变,再以2︰2︰1的体积比充入A、B和C,则
A. 平衡向正方向移动
B. 平衡不移动
C. C的百分含量增大
D. C的百分含量可能减小
某温度下,密闭容器中发生反应aX(g) 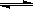 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数数:a>b+c |
| B.压缩容器的容积时,v正增大,v逆减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |
将 lmolSO2和 l mol O2通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是()
| A.0.3mol | B.0.15mol |
| C.小于 0.15mol | D.大于0.15mol而小于 0.3mol |
在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响,如CaAl2Si2O8 + Mg2SiO4 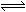 CaMg2Al2Si3O12
CaMg2Al2Si3O12
(钙长石)(镁橄榄石) (钙镁)石榴子石
密度: 2.70 3.22 3.50g·cm-3
则在地壳区域高压条件下,有利于
| A.钙长石生成 | B.镁橄榄石生成 |
| C.钙长石和镁橄榄石共存 | D.(钙镁)石榴子石生成 |