已知某化工厂的含镍催化剂主要含有Ni,还含有Al (31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。某校化学研究性学习小组通过查阅资料,设计了如下图所示的方法以该含镍废催化剂为原料来制备NiSO4·7H2O。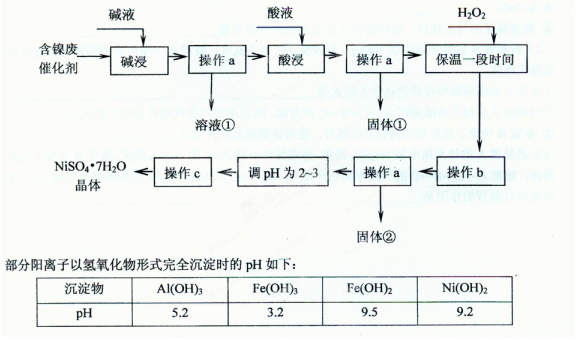
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(2)“碱浸”的目的是除去 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(5)“调pH为2~3“的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
(7) NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式___ 。
(8)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 和可逆反应Fe2++ 2H2O 2H++ Fe(OH)2在25℃时的平衡常数
2H++ Fe(OH)2在25℃时的平衡常数
“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是
| A.非金属单质燃烧时火焰均为无色 |
| B.NaCl与Na2CO3灼烧时火焰颜色相同 |
| C.焰色反应均应透过蓝色钴玻璃观察 |
| D.只有金属单质灼烧时火焰才有颜色 |
下列反应的离子方程式书写正确的是( )
| A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3?H2O |
| B.氧化钠与水反应:O2—+H2O = 2OH- |
| C.碳酸钙溶于醋酸:CaCO3 + 2H+ |
| D.氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 |
下列叙述正确的是()
| A.有氧元素参加的反应一定是氧化还原反应 |
| B.反应前后元素化合价没有变化的反应一定不是氧化还原反应 |
| C.某元素在化学反应中,由化合态变为游离态,则该元素一定被还原 |
| D.氧化还原反应中,一种物质被氧化,另一种物质必被还原 |
据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是
| A.O4的摩尔质量是64 g |
| B.O4与O2互为同位素 |
| C.相同质量的O4与O3所含原子个数之比为1∶1 |
| D.O4与O3、O2都是氧元素的同分异构体 |
下列类型的反应,一定发生电子转移的是
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |