某小组为研究电化学原理,设计如图2装置。下列叙述不正确的是( )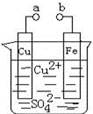
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA |
| B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.标准状况下,0.1molCl2溶于水,转移的电子数目小于0.1NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是
| A.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| B.日本福岛核电站爆炸时释放的两种放射性核素13153I与13755Cs的中子数相等 |
| C.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D.海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 |
由氧化铜和氧化铁组成的混合物a g,加入2 mol·L-1的稀硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
| A.1.6a g | B.(a-1.6) g | C.(a-3.2) g | D.无法计算 |
某有机高分子由 、-CH2-CH2-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是
、-CH2-CH2-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是
A.2︰1B.8︰7 C.2︰3 D.1︰1
某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6===6C+LiCoO2,其电池如图所示。下列说法不正确的是
| A.放电时,LixC6发生氧化反应 |
| B.充电时,Li+通过阳离子交换膜从左向右移动 |
| C.充电时将电池的负极与外接电源的负极相连阳离子交换膜 |
| D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2 |