用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、降温;④转移、洗涤;⑤定容、摇匀。回答下列问题
(1)所需浓硫酸的体积是  ;
;
(2)第⑤步实验的具体操作是
 。
。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视溶液的液面
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项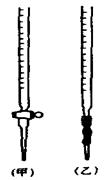
| 锥形瓶中的溶液 |
滴定管中的溶液 |
选用指示剂 |
选用滴定管 |
|
| A |
碱 |
酸 |
石蕊 |
(乙) |
| B |
酸 |
碱 |
酚酞 |
(甲) |
| C |
碱 |
酸 |
甲基橙 |
(甲) |
| D |
酸 |
碱 |
石蕊 |
(乙) |
实验室可用如下装置(略去部分夹持仪器)制取SO2并验证其性质。
(1)盛装70%H2SO4溶液的仪器名称为_______。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若_______,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择_______(填代号)。
a.蒸馏水b.饱和Na2CO3溶液
c.饱和NaHSO3溶液d.饱和NaOH溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为_______。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加人品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案合理的是方案_______(填“I”、“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为__________________________________________.
(5)装置E的作用是_______。装置F中为_______溶液。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: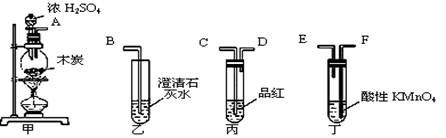
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接,接,接B ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中,丙中;
(3)丁中酸性KMnO4溶液的作用是;
(4)写出甲中反应的化学方程式并用单线桥标明电子转移的方向和数目:。
(5)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
| A.脱水性 | B.酸性 | C.强氧化性 | D.吸水性 |
Ⅰ.在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。()
Ⅱ.Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 ()
Ⅲ.向滤纸上滴加浓H2SO4 ,滤纸变黑。()
Ⅳ.在冷浓H2SO4中放入铁片没明显现象()
如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、锌粒、稀盐酸、二氧化锰、氯化铵、熟石灰。现利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题: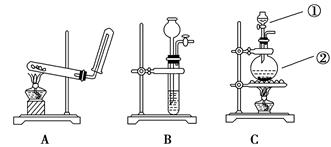
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;通常选用C装置制取的气体有__________________。
(2)标号为 ①、② 的仪器名称依次是________、________。
(3)写出利用上述有关药品制取Cl2的化学方程式: ________。
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。
(1)根据图A写出实验室制取氨气的化学方程式_________________________;
如何检验氨气已经收集满。
(2)甲同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到的实验现象是______________________________________________。根据实验现象说明氨气具有的性质是_____________________________________。