已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol  2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
常温下,取体积比为2:3的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ( )
| A.0.2Q1+0.15Q3 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.1Q2 |
下列实验装置或操作正确的是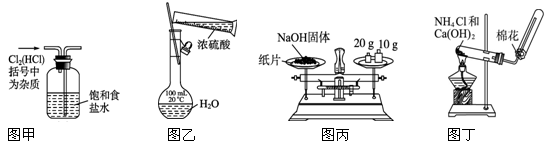
| A.图甲:除去Cl2中混有的HCl | B.图乙:用浓硫酸配制一定浓度的稀硫酸 |
| C.图丙:称量氢氧化钠固体 | D.图丁:实验室制备氨气 |
下列过程中没有发生氧化还原反应的是
| A.天然气燃烧提供热量 |
| B.氯水使红色纸张褪色 |
| C.钢铁制品在空气中被腐蚀 |
| D.二氧化硫通人品红溶液中,溶液褪色 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是
| A.K+、MnO4-、Na+、Cl- | B.K+、Ba2+、NO3-、Cl- |
| C.Na+、HCO3-、NO3-、SO42- | D.Fe3+、Na+、Cl-、SO42- |
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是
| A.盐酸 | B.氨水 | C.烧碱溶液 | D.KSCN溶液 |
下列实验能达到实验目的的是
| A.用100mL容量瓶量取50mL水 | B.用四氯化碳萃取碘水中的碘 |
| C.用浓硫酸干燥氨气 | D.用pH试纸测定氯水的pH |