LiAlH4( )、LiH
)、LiH 既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是
既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是
| A.LiH与D2O反应,所得氢气的摩尔质量为4 g/mol |
| B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+2H2O===LiAlO2+4H2↑ |
| D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
下列各组物质中,化学键类型完全相同的是
| A.Na2O2和NaOH | B.Mg3N2和NaOH | C.CCl4和H2O2 | D.N2H4和H2O2 |
肼(N2H4)分子中所有原子均达到稀有气体原子的稳定结构,它的沸点高达113℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃料电池。已知肼的球棍模型如图所示,下列有关说法正确的是()
| A.肼是由极性键和非极性键构成的非极性分子 |
| B.肼沸点高达l13℃,可推测肼分子间能形成氢键 |
| C.肼燃烧的热化学方程式为:N2H4(g)+ O2(g) = N2(g) +2H2O(g);△H = -642 kJ·mol-1 |
| D.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH- |
下列叙述正确的是
①锌跟稀硫酸反应制H2加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白铁比马口铁更耐腐蚀;③电镀时,应把镀件置于电解槽的阳极;④冶炼铝时,将AlCl3加热成为熔融体后电解;⑤钢铁制品长期露置于潮湿空气中表面常易发生电化腐蚀生成Fe2O3·nH2O;⑥电解精炼铜时,将粗铜置于电解槽的阴极
| A.全部 | B.①②⑤ | C.①③⑤ | D.①③④ |
下列实验过程中,产生的现象与对应的图形相符合的是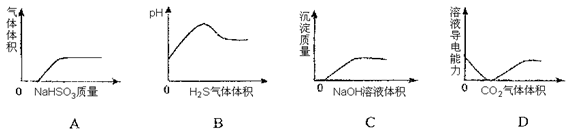
| A.将NaHSO3粉末加入HNO3溶液中 |
| B.将H2S气体通入氯水中 |
| C.将NaOH溶液滴入Ba(HCO3)2溶液中 |
| D.将CO2气体通入澄清石灰水中 |
如图a、b、c、d均为铂电极,供选择的电解质溶液如下表: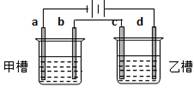
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
| 组 |
A |
B |
C |
D |
| 甲槽 |
NaOH |
Cu(N O3)2 |
KCl |
Na2SO4 |
| 乙槽 |
CuSO4 |
NaCl |
AgNO3 |
NaNO3 |