下列能区分胶体和溶液的最佳方法是( )
| A.静置,有沉淀现象的是胶体 | B.有丁达尔效应的是胶体 |
| C.能透过滤纸的是溶液 | D.用肉眼观察,均一透明的是溶液 |
下列关于晶体的说法一定正确的是( )
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.以上说法都不正确。 |
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如下图,则下列判断错误的是 ( )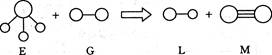
| A.G是最活泼的非金属单质 | B.L是极性分子 |
| C.E能使紫色石蕊试液变蓝色 | D.M化学性质活泼 |
下列有关说法中,不正确的是()
| A.离子晶体的晶格能越大,离子晶体的熔点越高 |
| B.碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为CCl4和I2都是非极性分子,而H2O是极性分子 |
| C.成键原子的原子轨道重叠越多,共价键越牢固 |
| D.含有金属阳离子的晶体一定是离子晶体 |
下面叙述正确的是 ( )
| A.共价化合物中没有离子键 |
| B.离子化合物中没有共价键 |
| C.正四面体构型的分子,键角均为109°28' |
| D.直线型分子中的键角均为180° |