相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g) 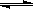 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是 ( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣ 2CO32﹣+6H2O,则下列说法错误的是()
2CO32﹣+6H2O,则下列说法错误的是()
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O |
| D.充电时每生成1molCH3OH转移6mol电子 |
应用元素周期律分析下列推断,其中正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②Cs是第ⅠA族元素,Cs失电子能力比Na的强
③砹(At)是第VIIA族,其氢化物的稳定性大于HCl
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱.
| A.①③⑤ | B.①②⑤ | C.②③⑤ | D.①②④ |
山梨酸(CH3﹣CH=CH﹣CH=CH﹣COOH)是一种常用的食品防腐剂.下列关于山梨酸性质的叙述中,不正确的是
| A.可与钠反应 |
| B.可与碳酸钠溶液反应 |
| C.可与溴的四氯化碳溶液发生取代反应 |
| D.可生成高分子化合物 |
以下实验能获得成功的是
| A.将铁屑、溴水、苯混合制溴苯 |
| B.在苯中滴入浓硝酸制硝基苯 |
| C.用乙醇和乙酸混合共热制取乙酸乙酯 |
| D.将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.0.1 mol•L﹣1NaCl溶液中含有0.1NA个Na+ |
| B.标准状况下,22.4 L 苯含有NA个苯分子 |
| C.7.8 g Na2O2与足量水反应转移0.2NA个电子 |
| D.标准状况下,2.24 LCH4和C2H4混合气体中含有的H原子数为0.4NA |